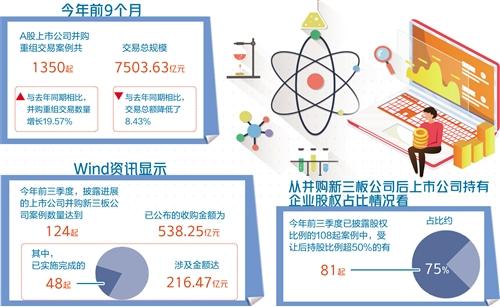
在大約一半的阿爾茨海默病(AD)患者、大多數(shù)海馬硬化患者和其他幾種癡呆癥患者中,都存在反式激活反應(yīng)DNA結(jié)合蛋白43(TDP-43)失調(diào),并且與認(rèn)知障礙有關(guān)[1-5]。
 (資料圖片僅供參考)
(資料圖片僅供參考)
TDP-43是一種在細(xì)胞核中廣泛存在的蛋白質(zhì),TDP-43的錯誤定位、缺失或突變可以引起細(xì)胞功能缺陷和毒性,盡管已經(jīng)在多種神經(jīng)系統(tǒng)疾病中發(fā)現(xiàn)了TDP-43病理變化,但TDP-43導(dǎo)致發(fā)病和認(rèn)知障礙的機(jī)制還是個謎。
在最近的《科學(xué)·進(jìn)展》雜志上,一項(xiàng)新研究[6]發(fā)現(xiàn),星形膠質(zhì)細(xì)胞細(xì)胞質(zhì)中TDP-43的積累促進(jìn)干擾素誘導(dǎo)的趨化因子基因表達(dá),產(chǎn)生過量的趨化因子,激活海馬神經(jīng)元的趨化因子受體,改變突觸前功能并使神經(jīng)元過度興奮,從而導(dǎo)致認(rèn)知障礙的發(fā)生。
神經(jīng)膠質(zhì)細(xì)胞和神經(jīng)元中功能失調(diào)的TDP-43均可以導(dǎo)致神經(jīng)系統(tǒng)疾病,但小鼠研究顯示,在運(yùn)動神經(jīng)元中選擇性敲除突變的TDP-43可延遲疾病發(fā)作,但并不影響疾病進(jìn)展,因此,非神經(jīng)元中的TDP-43可能才是長期病理進(jìn)展的罪魁禍?zhǔn)譡7]。
星形膠質(zhì)細(xì)胞的TDP-43靶向敲除可以引起運(yùn)動障礙[8],而且肌萎縮性脊髓側(cè)索硬化癥(ALS)患者來源的誘導(dǎo)性多能干細(xì)胞衍生的星形膠質(zhì)細(xì)胞也表現(xiàn)出細(xì)胞質(zhì)中自主的TDP-43積累[9]。
因此,研究人員首先利用尸檢海馬切片對AD、額顳葉癡呆(FTD)患者和非癡呆對照組星形膠質(zhì)細(xì)胞中TDP-43的亞細(xì)胞水平進(jìn)行了評估,與對照組相比,AD患者海馬星形膠質(zhì)細(xì)胞中彌漫性核外TDP-43水平增加了89%,散發(fā)型和家族型FTD患者中也有類似的現(xiàn)象。
AD和FTD患者核外TDP-43水平顯著增加
研究人員對小鼠進(jìn)行了轉(zhuǎn)基因,使小鼠的星形膠質(zhì)細(xì)胞靶向表達(dá)人類的TDP-43突變形式,在細(xì)胞質(zhì)中積累。
小鼠在3-4個月齡時,在水迷宮實(shí)驗(yàn)中表現(xiàn)出正常的學(xué)習(xí)能力,1天后進(jìn)行的記憶能力測試中表現(xiàn)正常,但3天后的重復(fù)測試表現(xiàn)出中度記憶能力受損。到了9-10月齡時,小鼠在1天和3天時的記憶能力測試表現(xiàn)都很糟糕,但游泳和學(xué)習(xí)能力沒有受到影響。12月齡時,小鼠在識別新物體方面也出現(xiàn)了問題。這樣的變化表明,星形膠質(zhì)細(xì)胞TDP-43細(xì)胞質(zhì)積累會引起進(jìn)行性記憶障礙。
與Tau-P301S小鼠(表達(dá)tau和MAPT*P301S突變的AD和FTD模型)海馬基因表達(dá)廣泛變化相比,TDP-43突變小鼠的海馬基因表達(dá)具有高度選擇性,干擾素(IFN)誘導(dǎo)的趨化因子Cxcl9和Cxcl10是受影響最大的基因,在海馬中表達(dá)大量增加,但在其他腦區(qū)中變化極小,CXCL9和CXCL10的增加也局限于海馬星形膠質(zhì)細(xì)胞,其他腦區(qū)的神經(jīng)元、小膠質(zhì)細(xì)胞/巨噬細(xì)胞或星形膠質(zhì)細(xì)胞中沒有這種變化,與此前在AD患者中的發(fā)現(xiàn)相似。
Cxcl10(B)和Cxcl9(C)的表達(dá)在海馬(HP)中大量增加
體外培養(yǎng)的結(jié)果顯示,IFN誘導(dǎo)的多個基因的變化至少部分是細(xì)胞自主的,分離的星形膠質(zhì)細(xì)胞中觀察到磷酸化NF-κB水平的增加,支持TDP-43功能障礙影響星形膠質(zhì)細(xì)胞中免疫相關(guān)信號通路的觀點(diǎn)。
實(shí)驗(yàn)顯示,與對照組相比,TDP-43積累后,星形膠質(zhì)細(xì)胞水皰性口炎病毒(VSV)、腺病毒和單純皰疹病毒-1(HSV-1)感染水平增加,這表明,TDP-43功能障礙不僅影響認(rèn)知功能,還會使抗病毒反應(yīng)受損,這可能使患者易患病毒性傳染病。
雖然TDP-43直接影響星形膠質(zhì)細(xì)胞,但小鼠的記憶能力受損,說明星形膠質(zhì)細(xì)胞和神經(jīng)元之間一定發(fā)生了什么,IFN誘導(dǎo)的趨化因子CXCL9和CXCL10能夠激活相應(yīng)的受體CXCR3,這一受體在神經(jīng)元、小膠質(zhì)細(xì)胞和其他一些細(xì)胞中表達(dá),不過海馬CXCR3主要在神經(jīng)元中表達(dá),看來CXCR3嫌疑很大。
研究人員發(fā)現(xiàn),小鼠海馬Cxcr3RNA和CXCR3水平確實(shí)增加了,CXCR3和不同突觸前突觸后標(biāo)志物的共免疫標(biāo)記顯示,CXCR3選擇性地在突觸前標(biāo)志物突觸素陽性點(diǎn)內(nèi)增加了2倍,在突觸后密度蛋白-95(PSD-95)或橋尾蛋白陽性點(diǎn)內(nèi)則沒有,這表明,海馬CXCR3的增加僅發(fā)生在突觸前末端。
Cxcr3表達(dá)明顯增加
長期、慢性的CXCR3刺激增加了自發(fā)的神經(jīng)元活動,神經(jīng)元放電長期增加,從而產(chǎn)生了認(rèn)知障礙。研究人員嘗試阻斷了小鼠海馬神經(jīng)元CXCR3,小鼠在水迷宮中的表現(xiàn)恢復(fù)到和野生小鼠同樣的水平,佐證了星形膠質(zhì)細(xì)胞TDP-43功能障礙以CXCR3依賴性的方式導(dǎo)致記憶能力受損。
研究人員表示,這提示他們,為了有效治療AD和癡呆,需要同時考慮星形膠質(zhì)細(xì)胞和神經(jīng)元,目前,CXCR3阻斷劑已經(jīng)在臨床試驗(yàn)中用于治療關(guān)節(jié)炎和其他炎癥性疾病,他們希望能夠在癡呆患者中使用這些藥物進(jìn)行測試。
參考文獻(xiàn):
[1] Uryu K, Nakashima-Yasuda H, Forman M S, et al. Concomitant TAR-DNA-binding protein 43 pathology is present in Alzheimer disease and corticobasal degeneration but not in other tauopathies[J]. Journal of Neuropathology & Experimental Neurology, 2008, 67(6): 555-564.
[2] Davidson Y S, Raby S, Foulds P G, et al. TDP-43 pathological changes in early onset familial and sporadic Alzheimer’s disease, late onset Alzheimer’s disease and Down’s syndrome: association with age, hippocampal sclerosis and clinical phenotype[J]. Acta neuropathologica, 2011, 122: 703-713.
[3] Josephs K A, Murray M E, Whitwell J L, et al. Staging TDP-43 pathology in Alzheimer’s disease[J]. Acta neuropathologica, 2014, 127: 441-450.
[4] Nag S, Yu L, Capuano A W, et al. Hippocampal sclerosis and TDP‐43 pathology in aging and A lzheimer disease[J]. Annals of neurology, 2015, 77(6): 942-952.
[5] Buciuc M, Tosakulwong N, Machulda M M, et al. TAR DNA-Binding Protein 43 is associated with rate of memory, functional and global cognitive decline in the decade prior to death[J]. Journal of Alzheimer’s Disease, 2021, 80(2): 683-693.
[6] Licht-Murava A, Meadows S M, Palaguachi F, et al. Astrocytic TDP-43 dysregulation impairs memory by modulating antiviral pathways and interferon-inducible chemokines[J]. Science Advances, 2023, 9(16): eade1282.
[7] Ditsworth D, Maldonado M, McAlonis-Downes M, et al. Mutant TDP-43 within motor neurons drives disease onset but not progression in amyotrophic lateral sclerosis[J]. Acta neuropathologica, 2017, 133: 907-922.
[8] Peng A Y T, Agrawal I, Ho W Y, et al. Loss of TDP-43 in astrocytes leads to motor deficits by triggering A1-like reactive phenotype and triglial dysfunction[J]. Proceedings of the National Academy of Sciences, 2020, 117(46): 29101-29112.
[9] Serio A, Bilican B, Barmada S J, et al. Astrocyte pathology and the absence of non-cell autonomy in an induced pluripotent stem cell model of TDP-43 proteinopathy[J]. Proceedings of the National Academy of Sciences, 2013, 110(12): 4697-4702.
來自:奇點(diǎn)神思